Introduction :
Pour vivre, le corps consomme de l’oxygène (O2) et rejette du gaz carbonique (CO2) dans l’air qui nous entoure.
L’appareil respiratoire permet d’assurer la ventilation (inspiration – expiration) et les échanges gazeux d’O2 et de CO2 entre l’air et le sang.
Définition:
On parle d’insuffisance respiratoire lorsque l’appareil respiratoire devient incapable d’assurer l’oxygénation correcte du sang.
L’insuffisance respiratoire chronique (IRC) va accompagner de façon définitive la vie du patient.
L’IRC est une maladie progressive, souvent méconnue à ses débuts. Elle peut se révéler par une insuffisance respiratoire aiguë (IRA) d’apparition brutale. L’IRA est une urgence vitale.
L’IRC peut-être variable : de légère à modérée jusqu’à sévère ou grave.
L’IRC va persister avec un risque d’aggravation progressive et/ou d’exacerbation. Un suivi médical régulier est nécessaire auprès d’un Pneumologue.
Mécanismes de l’IRC :
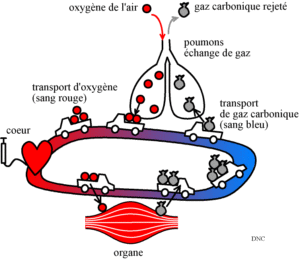
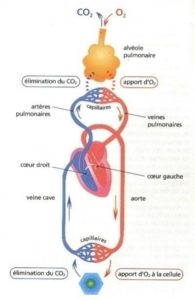
L’appareil respiratoire de l’être humain dispose de deux poumons. Chaque poumon contient des alvéoles qui reçoivent de l’air conduit par l’arbre trachéo-bronchique, et du sang contenu dans des vaisseaux sanguins capillaires. Air et sang sont séparés par une fine paroi que les gaz (02 et CO2) peuvent traverser. Les alvéoles s’appuient sur un tissu interstitiel.
Les poumons sont placés dans la cage thoracique. Les mouvements respiratoires (inspiration, expiration) se font grâce à des muscles dont le plus important est le diaphragme.
La circulation du sang qui contient les globules rouges est assurée par le cœur. L’oxygène est fixé sur l’hémoglobine contenue dans les globules rouges. La saturation normale de l’hémoglobine est au environ de 98 %.
À l’inspiration, une partie de l’oxygène qui est contenu dans l’air qui nous entoure est prélevé par l’organisme, et à l’expiration, le gaz carbonique produit par les cellules est rejeté hors de l’organisme.
La diminution prolongée de l’oxygène dans le sang conduit à une augmentation des pressions dans l’artère pulmonaire, avec en conséquence un risque d’insuffisance cardiaque droite.
Les besoins en oxygène varient en fonction de l’activité. Il y a donc une adaptation respiratoire permanente, contrôlée par des centres nerveux situés dans le cerveau. La fréquence respiratoire (FR) et le volume respiratoire entre chaque inspiration expiration (le volume courant, dit VT) peuvent augmenter ou diminuer entre l’effort ou le repos.
Symptômes :
Le principal symptôme est l’essoufflement (dyspnée en terme médical), mais aussi une fatigue ou une cyanose (coloration bleutée des doigts ou des lèvres par manque d’oxygène).
La dyspnée d’effort n’est pas normale lorsqu’elle apparaît en marchant ou grimpant quelques étages d’escalier à allure normale.
Les activités physiques peuvent devenir extrêmement réduites avec une sédentarité quasi totale, et un handicap sévère. On peut également observer des signes d’insuffisance cardiaque droite avec apparition d’œdèmes au niveau des jambes, traduisant une rétention d’eau avec alors une prise de poids. Les exacerbations fréquentes constituent un facteur aggravant.
Evaluation de l’IRC, définition de l’IRC grave :
L’insuffisance respiratoire chronique peut être la conséquence d’une ou de plusieurs lésions de l’ensemble des éléments constituant l’appareil respiratoire.
On peut mesurer les capacités respiratoires grâce aux explorations fonctionnelles respiratoires (EFR), la mesure directe des gaz du sang (pression artérielle d’oxygène : PaO2, pression de gaz carbonique : PaCO2). Les valeurs normales de PaO2 varient selon l’âge entre 100 et 80 mm Hg, la PaCO2 est plus fixe entre 38 et 42 mm Hg.
On définit l’insuffisance respiratoire grave lorsque la PaO2 est inférieure à 60 mm Hg, soit une saturation inférieure à 90 %.
Origines de l’IRC :
Les troubles les plus fréquents touchent la ventilation avec
Il peut y avoir aussi:
Il existe aussi des causes d’insuffisance respiratoire liées à des maladies cardiaques. Leurs prises en charge est alors avant tout cardiologique.
Ces pathologies sont donc très diverses. Leurs causes seront précisées selon le contexte par des examens complémentaires : scanners, prises de sang, fibroscopie bronchique, biopsies pulmonaires, échocardiographie … La plus fréquente est la BPCO.
Traitements de l’IRC :
La prévention est importante : l’arrêt du tabac, les vaccinations contre la grippe et contre le pneumocoque car l’IRC favorisent les infections respiratoires sources d’aggravation et de décès.
Certains médicaments comme les anxiolytiques et les morphiniques peuvent aggraver l’IRC et entrainer une IRA. Attention à l’automédication : Il ne faut pas prendre de traitement médicamenteux quel qu’il soit, sans l’avis préalable d’un professionnel de santé.
Pour chaque pathologie le choix du traitement sera différent.
Des dispositifs variés sont utilisables : flacons aérosol doseur (à commande manuelle avec ou sans chambre d’inhalation, ou bien auto-déclenché), les systèmes à poudre à inhaler (dispositif spécifique intégré ou gélules à perçer).
Enfin il est important de souligner quatre points :
Dans la suite, pour les maladies les plus fréquemment rencontrées (BPCO, asthme, fibrose pulmonaire, apnées du sommeil, mucoviscidose, maladies neuromusculaires), nous préciserons notamment les populations touchées, la fréquence, les centre de références spécifiques s’il en existe, l’origine, les particularités, les liens internet utiles avec les associations de patients.
Pour autant ces informations ne dispensent pas de l’avis médical auprès du Généraliste ou du Pneumologue traitant.
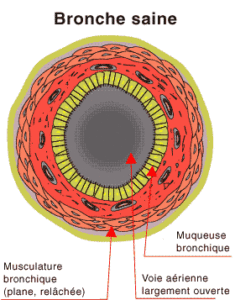
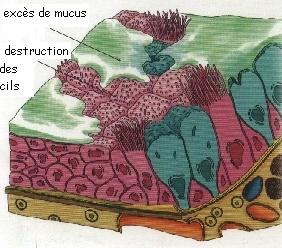
La BPCO se definit par une obstruction irréversible des voies aériennes, le plus souvent progressive. La BPCO n’est pas synonyme de l’emphysème qui est une destruction du parenchyme pulmonaire (en pratique reconnu au scanner), ni de la bronchite chronique (définie par une toux et des crachats -ou expectorations- durant au moins 3 mois et sur 2 années consécutives).
Fréquence : Elle est estimée à 7,5% dans une population de plus de 40 ans ; l’incidence semble se stabiliser chez l’homme et augmenter chez la femme soit 3 millions de personnes en France. Mortalité : En 2006, les taux bruts de mortalité par BPCO étaient de 41/100 000 chez les hommes et 17/100 000 chez les femmes âgées de 45 ans et plus. Elle est responsable 16 000 décès par an.
C’est la première cause d’oxygénothérapie à domicile.
Population touchée : 
Les fumeurs dans 80 % des cas (chez l’homme, si plus de 20 paquets/années, chez la femme, si plus de 15 paquets/années, associé ou non à l’inhalation de cannabis, incluant le tabagisme passif). Un paquet/année : un paquet de cigarette soit 20 grammes de tabac, par jour pendant un an.
Dix à 20 % des BPCO seraient d’origine professionnelle.
Type d’atteinte : La bronchopneumopathie chronique obstructive (BPCO) est une pathologie caractérisée par une atteinte des bronches avec initialement les petites voies aériennes et/ou une destruction du parenchyme pulmonaire (emphysème).
Conséquences broncho-pulmonaires et générales
Au niveau broncho-pulmonaire, on note un remaniement des parois bronchiques qui conduisent à une limitation des débits aériens. C’est l’obstruction qui est mesurée en EFR.
Elle peut entraîner une distension pulmonaire puisqu’il existe une difficulté à “vidanger” les poumons à l’expiration. De plus, la structure du poumon peut s’altérer avec l’apparition de l’emphysème.
Des mécanismes inflammatoires complexes sont liés à l’inhalation des substances toxiques et provoquent ces lésions bronchiques ou pulmonaires.
Au niveau général, là encore par le biais de phénomènes inflammatoires, on observe des altérations de différents organes, notamment au niveau musculaire et vasculaire.
Si la BPCO est une maladie à point de départ respiratoire, elle constitue aussi une maladie avec des conséquences générales sur l’organisme.
Centre de référence : Non en soins usuels, oui pour les greffes éventuelles ou les coils.
Origine génétique : Possible mais non élucidée de façon prédominante. Recherche du rare déficit en alpha 1 anti trypsine (10 000 cas en France).
Prévention primaire : Abstinence tabagique, prévention pollution professionnelle et environnementale.
Particularité évolutive :
Dégradation progressive souvent silencieuse surtout au début.
Exacerbations, facteurs favorisant : infections virales ou bactériennes, pollution atmosphérique, interruption du traitement médicamenteux ; inconnus dans 30% des cas.
Sédentarisation et déconditionnement.
Comorbidités avec notamment dépression, atteintes cardio-vasculaires, musculaires.
Insuffisance respiratoire aiguë : réanimation respiratoire, ventilation non invasive ou ventilation artificielle.
Traitement usuel :
La prise en charge est multidisciplinaire : pneumologues, médecins généralistes, kinésithérapeutes, médecin de médecine physique et de réadaptation, pharmaciens, infirmier(e)s, diététicien(ne), etc.
Médicaments : Broncho-dilatateurs de longue durée d’action plus ou moins corticoïdes inhalés, théophylline rarement en 2019.
Prévention primaire : L’abstinence tabagique, la lutte contre les pollutions professionnelles ou environnementales
Prévention secondaire : vaccinations contre la grippe et le pneumocoque.
Education thérapeutique : Oui
Kinésithérapie respiratoire : Oui
Réhabilitation respiratoire: Oui, efficacité démontrée depuis les années 90.
Greffe pulmonaire : Très rarement en fait, contre-indication après 65 ans, pour les formes graves après élimination des contre-indications, sur avis du centre de référence (CHU Strasbourg)
Assistance respiratoire : O2, VNI
Particularité thérapeutique : Coils ou valves, dispositifs mis en place par voie endos bronchique après avis du Centre Spécialisé, concernent les emphysèmes sévères.
Pronostic :
Risque d’insuffisance cardiaque droite, d’exacerbations fréquentes, d’altération de la qualité de vie, de handicap et de désocialisation, de mortalité précoce ou lors d’épisodes d’IRA.
Maladie professionnelle : Oui, mineurs de charbon et de fer (tableaux MP 91 et MP 94 du Régime Général)
Liens internet utiles :
Associations de patients :
Définition :
L’asthme est une maladie inflammatoire chronique des voies aériennes qui se caractérise par des symptômes de brève durée spécifiques (essoufflement brutal, sifflement, toux, oppression), réversibles spontanément ou sous l’effet d’un traitement, et des exacerbations potentiellement graves. Les crises d’asthme peuvent durer de plusieurs minutes à quelques heures. Entre deux crises, la respiration redevient normale. La fréquence et l’intensité des crises d’asthme varient selon les individus.
Il se manifeste, en réaction à des facteurs environnementaux.
Il peut évoluer vers la chronicité et vers l’IRC s’il n’est pas traité et contrôlé correctement. La dégradation peut être progressive et non perçue rapidement. C’est ce qui justifie le suivi en EFR au moins annuellement. L’auto-mesure du souffle par le débit expiratoire de pointe (DEP ou Peak-flow) complète l’évaluation des symptômes pour évaluer la gravité et adapter les traitements.
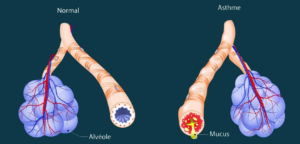
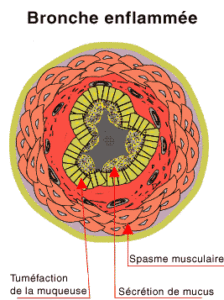
Mécanismes :
On distingue les asthmes allergiques et les asthmes non allergiques.
Les bronches de l’asthmatique présente une inflammation bronchique. Elles sont sujettes aux phénomènes de bronchospasmes (contractions des muscles bronchiques) et d’hyper-réactivité bronchique (chronique ou non), avec un remodelage bronchique au fil du temps.
Cela explique la variabilité du souffle, qui est détecté en pratique par la mesure du DEP.
Les facteurs favorisants sont le plus souvent des allergènes (chez 70 à 80 % des adultes asthmatiques, et chez 95 % des enfants), mais la pollution, certaines expositions professionnelles interviennent également.
Fréquence : L’asthme touche environ 4 millions de personnes en France, et est responsable chaque année de près de 60 000 hospitalisations (38 000 chez les asthmatiques de plus de 15 ans) et presque 1 000 décès. L’asthme grave toucherait 1 à 3 % de la population générale chez les enfants et les adultes. En 2004, 117 308 patients étaient en ALD pour asthme.
Population touchée : L’asthme se rencontre à tout âge.
Depuis l’enfance, où la majorité des asthmes apparaît, jusqu’à l’âge adulte, la fréquence est estimée à 8 % des moins de 25 ans (près de 10 % chez les garçons) contre environ 5,5 % après, avant une augmentation vers 7 % chez les plus de 65 ans.
L’obésité est plus fréquente chez les asthmatiques.
Les femmes sont plus souvent touchées à l’âge adulte par des formes d’asthme non allergiques
Type d’atteinte :
L’inflammation bronchique est à l’origine des bronchospasmes, d’une augmentation des sécrétions bronchiques, et progressivement du remodelage des bronches qui explique la survenue d’une obstruction bronchique chronique.
Origine génétique :
L’asthme est une maladie multifactorielle qui nécessite à la fois une prédisposition génétique et une exposition à un facteur favorisant (la cause : par exemple les pollens).
La notion d’allergie ou d’asthme familial est souvent rencontrée. Les mécanismes génétiques sont multiples et non encore élucidés.
Prévention primaire :
Eviction du facteur déclenchant (importance de la recherche de la cause). Abstinence tabagique, prévention pollution professionnelle et environnementale.
Particularité évolutive :
On distingue trois niveaux d’appréciation dans l’asthme :
Et quatre profils évolutifs : intermittent, persistant léger modéré et sévère.
Traitement usuel :
Le contrôle de l’environnement et l’éducation thérapeutique (ETP) sont incontournables dans la prise en charge thérapeutique.
Les atteintes ORL, le reflux gastro-œsophagien sont à prendre en compte si besoin.
Le traitement des crises repose sur l’inhalation d’un béta 2 mimétiques, dont l’efficacité est très souvent spectaculaire en quelques minutes.
Mais la prise en charge de l’asthme repose sur l’évaluation du contrôle de la maladie chronique et non pas seulement sur le traitement des crises.
Médicaments :
Adapter le traitement en fonction de l’évolution et du traitement préalablement reçu.
Prévention primaire :
Eviction des allergènes, protection contre les substances irritantes (lutte antipollution, aération des lieux de travail)
Prévention secondaire : vaccinations contre la grippe et le pneumocoque.
Education thérapeutique : Oui. Elle aide à comprendre la maladie, à maîtriser les traitements notamment les techniques d’inhalation, à mettre en place un plan personnalisé de soin.
Kinésithérapie respiratoire : Maîtriser la ventilation,
Réhabilitation respiratoire : Oui
Assistance ventilatoire : aérosols, OLD, ventilation mécanique en réanimation en cas d’asthme aigu grave
Particularité thérapeutique :
La désensibilisation en cas d’allergie prouvée déterminante.
Le plan d’action individualisé (Gestion par le patient) guidé par le DEP.
Prise en charge des co-morbidités : Manifestations allergiques ORL ou cutanées (rhinites eczéma), obésité, dépression-anxiété, reflux, migraines.
L’asthme d’effort : traitement prophylactique.
Certificats médicaux pour les sportifs de compétitions : justification médicale de la prise des traitements (contrôles anti-dopage).
Recours à un Conseiller Médical en Environnement Intérieur : pour rechercher des causes environnementales domestiques.
Pronostic :
Un asthme tôt et bien traité permet une vie quasiment normale.
Environ 1 à 3 pour cent des asthmes évolueraient vers l’IRC.
Centre de référence :
Pour les asthmes sévères : Réunion de concertation pluridisciplinaire (en cours de déploiement en 2019).
Pour les asthmes professionnels : service de consultations de maladies professionnelles CHU Nancy.
Pour les asthmes sévères de l’enfant.
Conseiller Médical en Environnement Intérieur : Association AP3A
Maladie professionnelle :
Les boulangers et pâtissiers (dû aux farines, contaminants de la farine, etc.) ;
Les professionnels de la santé (gants en latex, produits désinfectants, etc.) ;
Les coiffeurs (décolorants, teintures) ;
Les peintres (peintures, vernis, isolants pour bâtiments, etc.) ;
Le personnel des entreprises de nettoyage (détergents, acariens, etc.) ;
Les menuisiers (poussière de bois)….
Liens internet utiles :
Association AP3A
Associations de patients : FFAAIR
Les alvéoles reposent sur un tissu de soutien : l’interstitium. La densité de ce dernier peut être modifié au cours de diverses agressions qui vont entraîner une inflammation d’abord, puis une cicatrisation. Les fibroses pulmonaires sont l’évolution à un stade cicatriciel de nombreuses maladies (plus de 200) : les pneumopathies interstitielles diffuses (PID).
Le diagnostic des PID repose sur l’analyse du contexte (âge, sexe, origine ethnique, tabac, médicaments, antécédents personnels et familiaux, profession, maladies associées -granulomatoses- maladies du tissus conjonctif), et des examens complémentaires orientés parmi lesquels des bilans biologiques, la fibroscopie bronchique avec lavage broncho-alvéolaire, l’aspect scannographique et parfois la biopsie pulmonaire chirurgicale.
Certaines PID sont de causes connues, d’autres non.
Certaines n’atteignent que le poumon, d’autres touchent d’autres organes.
Certaines seront réversibles en partie ou en totalité si leur traitement est débuté le plus tôt possible.
Les maladies interstitielles pulmonaires les plus courantes sont:
Les PID peuvent se révéler d’emblée au stade de fibrose soit évoluer vers celle-ci, notamment si le diagnostic est retardé.
Arrivées au stade de fibrose, les lésions sont irréversibles. Elles peuvent être limitées ou diffuses, évolutives ou non, de gravité légère à majeure aboutissant alors à une IRC grave avec IRC et hypoxie sévère.
La fibrose pulmonaire idiopathique (c’est à dire sans cause retrouvée) est la plus fréquente des fibroses.
Fréquence :
La recherche sur la prévalence des maladies interstitielles pulmonaires est difficile, parce que les diagnostics spécifiques ne sont pas toujours obtenus.
Une étude (PID 93) estime la prévalence à 100/10000. Les trois plus fréquentes sont la sarcoïdose les PID des connectivites et la FPI, avec respectivement des taux de 30, 12, et 8 pour 100000.
Certaines études suggèrent que lorsque l’on ajoute les cas de fibrose pulmonaire idiopathique et ceux de sarcoïdose, ils représentent 50 % de toutes les maladies interstitielles pulmonaires.
La FPI est une maladie rare, avec une incidence estimée entre 0,2 et 7,4/100 000/an en Europe et entre 6,8 et 17,4/100 000/an aux Etats-Unis.
Population touchée :
Étant donné le nombre très important de PID, il n’est pas possible de faire un descriptif général.
La FPI touche plus souvent les hommes que les femmes à partir de la cinquantaine.
Type d’atteinte :
Cicatrisation laissant un interstitium anormal par sa structure, sa densité et sa rigidité.
Avec sept profils différents histologiques (prélèvements analysés au microscope).
La FPI correspond à l’aspect de PIC (pneumopathie interstitielle commune).
Au scanner, pour la FPI on recherche les critères de «PIC certaine» (réticulations à prédominance basale et sous-pleurale, opacités en rayon de miel) ou d’une «PIC possible» (idem sans les images en rayon de miel, et l’absence de caractéristiques non compatibles.
Centre de référence :
Les réunions de discussion multidisciplinaire (DMD) regroupent des Pneumologues, des Médecins Internistes, des radiologues et des anatomopathologistes pour étudier les dossiers, faite les propositions de bilans complémentaires, de traitement et de suivi.
Le centre de référence en Lorraine est le service de Pneumologie du CHU de Nancy.
Origine génétique :
Plusieurs mutations génétiques ont été associées à la FPI.
Prévention primaire :
Protection vis à vis des risques connus comme les inhalations de poussières pour les pneumoconioses,
Particularité évolutive :
Les exacerbations aiguës. Souvent secondaires à des infections virales ou bactériennes.
Traitement usuel :
Médicaments :
Les traitements sont variables selon la cause de la fibrose et si coexistent des atteintes potentiellement réversibles. Dans ce cas, les corticoïdes ou des immunodépresseurs peuvent se discuter.
Lorsque la fibrose de type PIC est présente les corticoïdes ne sont pas indiqués sauf pour les exacerbations.
FPI : Esbriet® (pirfenidone), OFEV® (nintédanib)
Prévention secondaire : vaccinations contre la grippe et le pneumocoque.
Education thérapeutique : oui
Kinésithérapie respiratoire : oui
Réhabilitation respiratoire : oui, avec souvent une oxygénothérapie.
Assistance ventilatoire : Oxygénothérapie souvent à forts débits
Particularité thérapeutique :
Eviction de l’agent causal lorsqu’il est connu (exemple arrêt d’un médicament, changement de profession)
Discussion des traitements spécifiques en DMD
Au stade avancé, la greffe pulmonaire
Pronostic :
Fonction de la cause et du type de lésion.
La FPI est de mauvais pronostic.
Maladie professionnelle :
Amiante (tableaux des MP 30 du régime général, silicose (MP 25).
Liens internet utiles :
Fondation du souffle– SPLF – GERMOP
Associations de patients : FFAAIR
Le syndrome d’apnées du sommeil se définit par des arrêts respiratoire D4une dizaine de secondes au moins se répétant au minimum cinq à 10 fois par heure de sommeil. L’index d’apnée-hyponée (IAH) est la fréquence par heure des apnées (arrêt total de la respiration, ou des hypopnées diminution de moitié). Selon l’IAH, on distingue des formes légères, modérés ou sévères.
Ces évènements respiratoires conduisent à une baisse de l’oxygénation (désaturation nocturne) et à des micro-éveils qui vont permettre la reprise de la respiration mais au prix d’une perturbation du sommeil qui est alors de moindre qualité.
Les SAS se manifestent de façon variée : fatigue, insomnie, somnolence, maux de tête, sommeil non réparateur, ronflement, irritabilité, perte de mémoire, bouche sèche au réveil, besoin d’uriner la nuit. Ils se voient fréquemment en cas d’hypertension, de diabète, de maladies cardio-vasculaires, et sont favorisés par l’excès de poids, la prise d’alcool, de sédatifs ou de médicaments myorelaxants, et par le tabac. Ils sont plus fréquents en présence de maladies cardio-vasculaires, de diabète, d’AVC, d’hypothyroïdie non traitée. Ils aggravent les traits dépressifs. Les symptômes ressentis sont évalués par des questionnaires (Echelle d’Epworth pour la somnolence, score de Pichot pour la fatigue par exemple).
Le risque d’accident de la route par endormissement au volant est élevé en l’absence de traitement. La conduite est alors contre-indiquée et le permis de conduire doit faire l’objet d’un renouvellement médical par la commission départementale du permis en cas de somnolence.
Le diagnostic se fait en pratique soit par un enregistrement des paramètres respiratoires en polygraphie soit en y associant l’enregistrement de l’électro-encéphalogramme s’il est nécessaire de préciser en détail le sommeil et les micro-éveils d’origine respiratoire.
Il s’agit d’une maladie fréquente, avec des manifestations diverses, dont les conséquences peuvent être graves avec des risques cardio-vasculaires et d’accident de la route par un endormissement au volant. La qualité de vie des patients et très souvent altérée.
On parle d’apnée obstructive, SAOS (obstruction des voies aériennes supérieures durant le sommeil) ou d’apnée centrale SACS (arrêt des mouvements respiratoires). Les SAOS sont les plus fréquents environ 80 % des SAS.
Fréquence : 1 à 5 % de la population surtout adulte.
Population touchée :
Pour les SAOS : les Hommes un peu plus que les femmes, après la cinquantaine, obèses ou en surpoids.
Pour les SACS, les insuffisants cardiaques sévères, les maladies neurologiques, la prise de certains médicaments (opiacés, sédatifs).
Les SAS se voient aussi chez les enfants qui ont souvent de grosses amygdales. Ils peuvent avoir des conséquences sur les apprentissages et le développement. Une chirurgie ORL se discute plus souvent que chez l’adulte.
Type d’atteinte :
Pour les SAOS : obstruction des voies aériennes supérieures avec différents mécanismes possibles : pharynx étroit, voile du palais « vertical », longue luette, grosses amygdales, rétrognathie (mâchoire inférieure ou mandibule en arrière, aspect de menton fuyant), cou court, et relâchement du tonus musculaire au cours du sommeil avec perte d’effet des muscles dilatateurs.
Les SAOS ont une obstruction mécanique (le collapsus des voies aériennes supérieures), le traitement par PPC ou OAM, parfois par chirurgie consiste à libérer suffisamment de passage à l’air pour que la respiration et le sommeil se normalisent.
Pour les SACS : lésions des centres respiratoires cérébraux en cas de maladies neurologiques (AVC, tumeurs notamment).
Origine génétique : non déterminée. Notion de cas familiaux possibles.
Prévention primaire : Mesure d’hygiènes de vies, lutter contre l’excès de poids, l’obésité, la prise d’alcool, de tabac, d’anxiolytiques.
Le risque d’accident de la route par endormissement au volant est élevé en l’absence de traitement. La conduite est alors contre-indiquée et le permis de conduire doit faire l’objet d’un renouvellement médical par la commission départementale du permis en cas de somnolence.
Particularité évolutive :
Tendance à l’aggravation au fil du temps soit de l’IAH soit des symptômes : un ronfleur simple pouvant devenir avec l’âge apnéique à traiter.
Certains SAS se complexifient avec coexistence de phénomènes obstructifs et centraux.
Lors d’amaigrissement important, soit par régime soit par chirurgie bariatrique, les IAH et les symptômes peuvent régresser au point de désappareiller les patients qui doivent rester surveiller.
L’IAH peut diminuer sous l’effet des mesures d’hygiène de vie. Après un AVC et sous l’effet des traitements spécifiques, l’IAH peut baisser ce qui fait rediscuter l’indication d’une PPC alors.
Traitement usuel :
Les indications dépendent de la gravité déterminée par l’IAH et des symptômes.
Le traitement comporte des mesures d’hygiène de vie (poids, tabac alcool).
La ventilation par pression positive continue (PPC) est le plus souvent proposée.
La PPC est indiqué si l’IAH est supérieur à 30 ou s’il est entre 10 et 30 avec plus de 10 micro-éveils d’origine respiratoire.
La PPC est appliquée chaque nuit par un masque (c’est ainsi qu’elle est souvent appelée par les patients) qui est nasal ou bucco nasal. Un appareil produit une pression d’air permanente conduite jusqu’au masque par un tuyau. Un humidificateur avec de l’eau est habituellement mise en place pour éviter le dessèchement de la bouche ou du nez. Le plus souvent, la PPC est définitive.
En cas de SACS, on peut recourir à une servo-ventilation qui combine une pression expiratoire et une aide inspiratoire variable sous réserve qu’il n’y ait pas d’insuffisance cardiaque sévère (FeVG inférieur à 45 %, FeVG =fraction d’éjection du ventricule gauche).
Un suivi est indiqué après la mise en route du traitement.
Un prestataire de soin à domicile, livre l’appareillage, explique le fonctionnement, adapte le masque qui est choisi par le patient (le masque doit être confortable et étanche pour éviter les fuites d’air autour du nez ou de la bouche) et surveille le bon déroulement du traitement et le bon fonctionnement de la PPC. Le télé-suivi permet le recueil quotidien des données du traitement (durée, IAH résiduel).
Une alternative à la PPC est l’orthèse d’avancement de la mandibule (OAM). Elle nécessite un avis dentaire préalable car il s’agit de dormir avec un appareil qui propulse la mandibule et évite ainsi le collapsus. L’OAM est indiqué en cas de refus de la PPC ou en cas d’échec, mais est moins efficace dans les formes sévères. La prise en charge par la Sécurité Sociale n’est faite que pour l’un ou l’autre des traitements (PPC ou OAM), avec la complémentaire santé. Pour les OAM, une partie du coût peut rester à charge du patient qui reçoit un devis du dentiste au préalable.
Médicaments : néant pour les SAS.
Prévention secondaire : Mesure d’hygiène de vie. Prise en charge diététique si besoin. Traitement des pathologies associées
Education thérapeutique : oui
Kinésithérapie respiratoire : non
Réhabilitation respiratoire : A discuter selon le contexte et les pathologies associées
Greffe pulmonaire : non
Particularité thérapeutique : Assistance ventilatoire :
SAS et BPCO ou SOH (syndrome d’hypoventilation liée à l’obésité) associés : une ventilation non invasive à deux niveaux de pression (VNI VNDP) peut se discuter si la PCO2 est élevée.
Pronostic : bon sous PPC pour les SAOS. Dépend en fait des pathologies associées cardio-vasculaires métaboliques ou neurologiques.
Centre de référence : non
Maladie professionnelle : non
Liens internet utiles :
Associations de patients : FFAAIR – APNÉES GRAND EST
Le syndrome d’apnées obstructives du sommeil chez l’enfant
Docteur Iulia Ioan, Professeur Cyril Schweitzer, Pneumopédiatres, Hôpital d’enfants, CHRU Nancy.
Importance :
Le syndrome d’apnées obstructives du sommeil (SAOS) touche 1 à 4 % des enfants et le ronflement primaire simple environ 10% des enfants. Le diagnostic de SAOS repose sur la présence des symptômes nocturnes et diurnes associée à un index d’apnée-hypopnée (IAH) > 1 par heure de sommeil sur la polysomnographie.
Causes et facteurs prédisposants :
Le SAOS est plus fréquent entre 3 et 8 ans, étant liée à l’hypertrophie des végétations et amygdales, secondaire aux infections virales.
L’obésité, les anomalies du massif facial ou des voies aériennes supérieures, les maladies génétiques (trisomie 21, syndrome de Prader-Willi) ou malformatives (syndrome de Pierre-Robin), les maladies neuro-musculaires sont des facteurs prédisposants pour le SAOS.
Symptômes :
Chez l’enfant, le SAOS se manifeste par des ronflements nocturnes, des pauses respiratoires constatées par les parents, une respiration buccale, un sommeil agité avec des réveils fréquents, des sueurs nocturnes ou une énurésie secondaire. Les symptômes diurnes sont la conséquence d’un mauvais sommeil et se reflète surtout sur les apprentissages et le comportement de l’enfant : troubles de concentration et d’attention à l’école, difficultés d‘apprentissage, irritabilité, hyperactivité, agressivité, fatigue.
Conséquences :
Non-traité, le SAOS est responsable d’un retard neurocognitif, et à long terme d’un retard de la croissance, des complications cardio-vasculaires telles que l’hypertension artérielle et hypertension pulmonaire, ou de complications métaboliques telle que le diabète.
Diagnostic :
La polysomnographie (PSG) en laboratoire du sommeil avec surveillance reste l’examen de rréférence pour le diagnostic du SAOS de l’enfant et la sévérité de SAOS. Le SAOS est considéré léger si l’IAH est entre 1 et 5/h, modéré si l’IAH est entre 5 et 10/h et sévère si l’IAH est > 10/h. Sous réserve de bien évaluer la compliance de l’enfant et de la famille, la PSG ambulatoire pourrait être proposée au domicile dans des cas particuliers ( avec le matériel installé à l’hôpital par des techniciennes / IDE spécialisées. Au retour de l’enfant à la maison, la surveillance périodique de la position des capteurs par les parents pendant la nuit. La polygraphie ventilatoire pourrait être utilisée chez l’enfant .
Traitement :
La prise en charge du SAOS de l’enfant dépend de la sévérité de SAOS et est dans la plupart des cas pluridisciplinaire, impliquant les pneumopédiatres / médecins du sommeil de l’enfant, les chirurgiens ORL et maxillo-faciaux, les orthodontistes et les kinésithérapeutes dans des centres de référence, qui ne sont cependant pas soumis à une labellisation spécifique.
Toute prise en charge du SAOS de l’enfant doit être accompagnée par des règles d’hygiène du sommeil et diététiques surtout en cas de surpoids ou obésité :
La chirurgie ORL est au premier plan dans la plupart des cas (80-90%) et est dominée par l’adénoïdectomie et/ou amygdalectomie.
Un traitement anti-inflammatoire local par corticoïdes intranasaux et général par antileucotriènes a montré son efficacité dans le SAOS léger ou résiduel après la chirurgie ORL. La prescription d’antileucotriènes est cependant discutée actuellement par rapport à la description de troubles induits du sommeil.
La prise en charge orthodontique est très importante chez l’enfant dès le plus jeune âge, les traitements pouvant corriger des anomalies du massif facial (rétrognathie, promaxillie, palais ogival) ou de l’articulé dentaire.
Chez les enfants ayant une respiration buccale, la rééducation myofonctionnelle oro-faciale est indiquée pour repositionner la langue dans la cavité buccale en corrigeant le dysfonctionnement de la musculature maxillaire et faciale.
La ventilation par pression positive continue (PPC) pendant le sommeil est réservée aux cas sévères persistants de SAOS et doit toujours être débutée sur des arguments cliniques et polysomnographiques. La PPC permet de délivrer une pression positive pendant toute la durée du cycle respiratoire de l’enfant. La pression délivrée est fixe. Une pression autopilotée pourrait être utilisée chez l’enfant de plus de 12 ans. Sa mise en place et son suivi doivent être réalisés par un pneumopédiatre ou un pédiatre formé au sommeil de l’enfant. Il faut privilégier le masque nasal surtout chez les jeunes enfants en raison du risque d’inhalation en cas de vomissements si un masque facial est utilisé. Dans le SAOS, la PPC est efficace avec amélioration rapide de la qualité du sommeil et de la forme de l’enfant dans la journée. Sur le plan neurocognitif, l’amélioration est généralement différée avec meilleures performances scolaires, capacité d’attention et concentration et une amélioration du comportement de l’enfant. La surveillance d’un traitement par PPC nécessite un suivi clinique ainsi que le recueil des données machine concernant l’observance, l’IAH résiduel, les fuites et l’enregistrement de l’oxymétrie ou de la capnographie transcutanée pendant une nuit de traitement (à 1 mois, 4 mois et 10 mois). Il est recommandé de réaliser dans le centre du sommeil tous les ans pour suivre l’évolution de SAOS avec la croissance de l’enfant. Pour cela, la PPC doit être arrêtée au moins 1 semaine avant l’enregistrement pour ne plus avoir les effets remanents de la PPC. L’observance de la PPC est importante pour obtenir les bénéfices cliniques du traitement. Si elle est inférieure à 112 heures sur 28 jours consécutifs, elle doit être analysée avec les parents et l’enfant et il faut mettre en oeuvre toutes les mesures appropriées pour l’améliorer. Un cas particulier chez l’enfant est l’hypercapnie qui accompagne le SAOS. Dans ce cas, la ventilation par PPC est indiquée en première intention et, si l’hypercapnie persiste, une ventilation non invasive (VNI) sera utilisée.
Pronostic :
Il est d’autant meilleur que le SAOS de l’enfant est traité tôt. Cela justifie d’informer les parents et l’entourage socio-éducatif. Le devenir à long terme n’exclut pas la récidive après chirurgie surtout chez les enfants présentant un SAOS sévère. Il dépend aussi des pathologies sous-jacentes en cas de malformations, d’atteinte neuro musculaire.
Retrouver l’interview du professeur Schweitzer et du Docteur Ioan, Pneumopédiatres, Hôpital d’enfants CHU NANCY
Fréquence : En France, en 2016, 6770 personnes sont prises en charge par le Régime général de l’Assurance Maladie. La mucoviscidose concerne un nouveau-né sur 4000.
Population touchée : Elle est diagnostiquée le plus souvent dans l’enfance, à la naissance, dans les premiers mois de vie ou avant 6 ans. Cependant, il existe des formes à révélation plus tardive.
Type d’atteinte :
Les principaux organes touchés sont :
Les poumons et les bronches : la mucoviscidose provoque un épaississement des sécrétions muqueuses qui recouvrent les bronches et une obstruction des petites bronches. Elle favorise également la survenue de surinfections répétées.
Le pancréas : les sucs pancréatiques ne sont plus suffisamment sécrétés, ce qui conduit à une mauvaise absorption des graisses et des troubles nutritionnels.
Les glandes sudoripares : augmentation de la concentration en ion chlorure dans la sueur.
Les glandes sexuelles chez l’homme.
D’autres atteintes peuvent apparaître au cours de l’évolution de la maladie, foie et voies biliaires.
Mécanismes :
Anomalie de la protéine CFTR (Cystic Fibrosis Transmembrane conductance Regulator). Les sécrétions ne contiennent pas assez d’eau. Elles s’évacuent difficilement.
Le test à la sueur qui est le premier examen réalisé en cas de doute retrouve un excès de sel dans la sueur.
Centre de référence : Les Centres de Ressources et de Compétences de la Mucoviscidose (CRCM). En Lorraine, CHU de Nancy.
Ils ont pour rôle d’établir le diagnostic de la mucoviscidose, de réaliser l’évaluation initiale, de choisir entre les options thérapeutiques et de coordonner les soins. Ouverts 7j/7 et 24h/24, présents dans toutes les régions, les CRCM sont des structures hospitalières pluridisciplinaires avec des médecins spécialistes de la mucoviscidose, des infirmiers, des kinésithérapeutes, etc.
Ils ont permis d’améliorer très nettement la survie des patients.
Origine génétique :
La mucoviscidose est une maladie autosomique récessive. Les deux parents, non malades, sont porteur du gène muté pour transmettre la maladie à un enfant (ils sont porteurs sains du gène).
Si deux parents “porteurs sains” d’une mutation du gène ont un enfant, il y a un risque de1 sur 4 que celui-ci soit atteint de mucoviscidose, à chaque grossesse.
La mutation la plus fréquente est la Delta F 508 sur le chromosome 7.
L’étude du gène de la protéine CFTR confirme le diagnostic.
Dépistage depuis 2002 chez tous les nouveau-nés.
Prévention primaire : Conseil génétique, diagnostic prénatal ou pré-implantatoire.
Particularité évolutive :
La mucoviscidose a des conséquences respiratoires, pouvant conduire à l’IRCO grave, des infections à germes particuliers, souvent résistant aux antibiotique (Pyocyanique principalement), des conséquences digestives (constipation, iléus chez l’enfant), nutritionnelles par atteinte du pancréas (malabsorption et diabète) et hépatique (risque de cirrhose), avec un retentissement sur le développement staturo-pondéral, mais aussi sur la fertilité.
Traitement usuel :
Médicaments : selon les besoins
Antibiotiques, hydratation, apport nutritionnel, vitamines, oligo-éléments, DNORNASE Alpha
Prévention secondaire : Eviter les contaminations (sujets infectés, lavage des mains), vaccinations contre la grippe et le pneumocoque.
Education thérapeutique : oui.
Kinésithérapie respiratoire : drainage pluri quotidien fondamental
Réhabilitation respiratoire : oui
Assistance ventilatoire : Aérosol de DORNASE Alpha, OLD, VNI
Greffe pulmonaire : oui
Particularité thérapeutique :
Prise en charge multidisciplinaire (CRCM, Centre de Ressources et de Compétences de la Mucoviscidose) initialement pédiatrique puis adulte : respiratoire, digestive, nutritionnelle, diabétique (Insuline), psychologique, avec médecins, infirmières, kinésithérapeutes, nutritionniste, psychologue, et équipe de greffe.
Pronostic : La survie s’est améliorée au cours des dernières années grâce aux prises en charge multidisciplinaire et aux CRCM.
En l’absence de traitement, la médiane de survie est de 3 à 5 ans.
En 2015 en France l’âge moyen de décès de 34 ans.
L’espérance de vie à la naissance est passée de 7 ans en 1965 à 47 ans en 2005.
L’IRCO est la complication sévère la plus fréquente. La greffe pulmonaire en est le traitement ultime.
Liens internet utiles :
Associations de patients : Vaincre la Mucoviscidose
La respiration comporte des mouvements respiratoires cycliques et permanents des côtes et des muscles respiratoires et du diaphragme. L’inspiration est normalement la phase active, correspondant à la mise en tension des muscles qui augmente la taille de la cage thoracique et l’expiration est normalement passive par retour élastique de la cage thoracique à sa position initiale qui précède l’inspiration suivante.
Elle repose donc sur des muscles respiratoires dont le principal est le diaphragme, qui sont commandés par le système nerveux central et périphérique.
L’atteinte d’un ou plusieurs de ces éléments entrainent une maladie neuro musculaire ou MNM.
Les MNM sont très nombreuses et variées dans leurs modalités d’apparition de l’enfance à l’âge adulte, leurs apparitions rapides ou progressives, leurs évolutions aiguës ou chronqiues. Elles atteignent soit le système nerveux ( avec dans sa partie périphérique les cellules motrices ou motoneurones, d’où les nerfs moteurs sont issus) soit les muscles et pouvant toucher les fibres musculaires dans leurs structures ou dans leur fonctionnement. Elles peuvent être d’origine génétique ou acquises, et alors de causes diverses, virales, toxiques, auto immunes, dégénératives.
Leur prise en charge est multidisciplinaire avec des centres de références régionaux ou nationaux.
Les bilans comportent selon le contexte des analyses biologiques (dosages des enzymes musculaires notamment), de l’imagerie musculaire (IRM, scanner, échographie et écho-cardiographie), des EFR et gaz du sang, des mesures de saturation nocturne souvent couplées au mesure de PCO2 transcutanée, des tests d’effort, des polygraphes ou polysomnographies, des EMG (électromyogrammes), des bilans métaboliques, des biopsies musculaires, des recherches génétiques ou auto immunes.
Lorsque les muscles respiratoires sont atteints, l’IRC qui s’en suit est de type restrictif avec une hypoventilation avec hypercapnie (augmentation de la PCO2), et souvent des déformations de la cage thoracique de type cypho-scoliose, et une toux est inefficace avec encombrement aggravant la dyspnée et l’insuffisance respiratoire.
Les symptômes révélateurs sont la faiblesse musculaire qui se manifeste souvent à la marche ou qui empêche le développement chez l’enfant, les douleurs musculaires, la fatigabilité, les difficulté à avaler, les troubles respiratoires, cardiaques les troubles cognitifs. Les troubles moteurs en font le handicap principal. La perte d’autonomie conduit alors à des appareillages en fauteuil roulant. La mortalité est liée à l’atteinte cardiaque ou respiratoire.
Les symptômes respiratoires comportent l’essoufflement, les maux de tête souvent au réveil (traduisant l’augmentation de la PCO2 ou hypercapnie synonyme d’hypoventilation), le sommeil perturbé et
La surveillance des EFR, et la mesure de la PCO2 grâce à la gazométrie artérielle sont indispensables pour l’instauration de la ventilation. Lorsque l’IRC est installée, arrive une nécessité de ventilation de longue durée. Cela implique des ventilateurs disposant de batteries avec des alarmes de sécurité car les patients neuro-musculaires deviennent dépendants de leurs respirateurs.
Elles sont particulièrement susceptibles d’être aggravées par la prise de certains médicaments (sédatifs, anxiolytiques, morphiniques, ou par les anesthésies avec notamment les curares) qui doivent être évités.
Fréquence :
Les maladies neuromusculaires les plus fréquentes sont :
Population touchée :
Variable selon chaque maladie : Les maladies génétiques se révèlent le plus souvent dès l’enfance
Type d’atteinte :
On les classe selon le niveau de l’atteinte :
Centre de référence : CHU de Nancy
Service de Neurologie
Référent : Pr RAFFO Emmanuel 03 83 15 50 85
Référent pôle enfant : Pr SCHWEITZER Cyril : 03 83 15 51 58
Référent neurologie : Pr DEBOUVERIE Marc : 03 83 85 15 17 80
Référent pneumologie : Pr CHABOT François : 03 83 85 15 40 08
Référent médecine interne : Pr JAUSSAUD Roland : 03 83 15 41 43
Service de Neurologie
Référent : PITTION-VOUYOVITCH Sophie
03 83 85 71 38
Prévention primaire :
La vaccination obligatoire a fait disparaître en France la poliomyélite qui a été la MNM la plus fréquente jusqu’au milieu du vingtième siècle.
Prévention secondaire :
Eviction des médicaments sédatifs, anxiolytiques, morphiniques, colimycine en cas de myasthénie, précaution en cas d’anesthésie même si l’intervention est « banale »,
Particularité évolutive :
L’évolution dépend de l’atteinte respiratoire, de l’encombrement bronchique et de la dépendance du respirateur, mais aussi de l’atteinte cardiaque, et de l’autonomie locomotrice. La perte de la dextérité manuelle est un obstacle à l’autonomie des soins respiratoires pour l’utilisation des appareils d’assistance respiratoire.
Traitement usuel :
Les ventilateurs disposent d’alarme (fréquence respiratoire, volume) qui indiquent les risques majeurs : arrêt respiratoire, ou débranchement.
Les risques et des contraintes de la trachéotomie comprennent :
Les aspirations bronchiques régulières pluriquotidiennes doivent être apprises et maîtrisées par le patient et son entourage surtout quand la dextérité manuelle est limitée ou absente. Elles doivent être suivre des règles d’hygiène car les infections sont fréquentes.
L’humidificateur doit être rempli régulièrement.
Le patient et son entourage doivent être informés des risques et des contraintes, et formés pour y faire face.
Prévention secondaire :
vaccinations contre la grippe et le pneumocoque.
Education thérapeutique : Oui. Formation des patients et de l’entourage.
Kinésithérapie respiratoire : Oui, désencombrement bronchique, aide à la toux.
Réhabilitation respiratoire : Non.
Greffe pulmonaire : Non
Assistance ventilatoire : aide à la toux, aérosol, ventilation, oxygénothérapie.
Particularité thérapeutique :
Prise en charge multidisciplinaire, soutien psychologique, kinésithérapie, ergothérapie, nutrition, soins à domicile….
Liens internet utiles :